


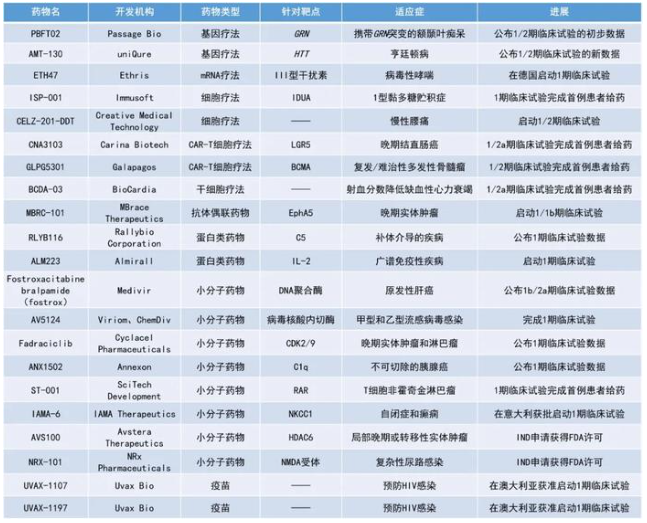
本期看点
1. 新型长效、小容量、皮下注射的补体成分5(C5)抑制剂RLYB116的1期研究结果积极,首次给药100 mg后24小时,游离C5的降幅超过99%。
2. 治疗携带GRN基因突变的额颞叶痴呆(FTD)的基因疗法PBFT02在早期临床研究中表现亮眼,前3名患者接受治疗1个月后,脑脊液中关键生物标志物水平均超过生理水平,1名患者已维持了6个月。
3. Fostrox联用激酶抑制剂lenvatinib治疗晚期肝细胞癌(HCC)展现积极结果,疾病控制率(DCR)达80%。
4. 治疗自闭症和癫痫的小分子疗法IAMA-6在意大利获批启动1期临床试验。
药明康德内容团队整理
RLYB116:公布1期临床试验数据

Rallybio公司公布了其新型长效、小容量、皮下注射C5抑制剂RLYB116的1期多剂量递增研究的初步数据。RLYB116正在开发用于治疗补体介导疾病。
此次公布的结果显示,每周一次皮下注射100 mg小容量(1 mL)的RLYB116可使游离C5的平均降幅持续保持在93%以上,包括在第29天最后一次给药前进行的测量。首次给药100 mg后24小时,游离C5的降幅超过99%。RLYB116的平均估计半衰期大于300小时。与每周给药100 mg相比,在每周给药两次、每次100 mg组的患者中观察到了更高的RLYB116浓度,且游离C5的平均降幅超过97%。
据观察,每周一次给药100 mg的RLYB116通常耐受性良好。队列中最常见的不良事件是注射部位反应(ISR),队列中有60%的受试者出现了这种反应。该初步结果支持继续开发RLYB116用于治疗全身性重症肌无力。
PBFT02:公布1/2期临床试验的初步数据

Passage Bio公布了正在进行的全球1/2期临床试验队列1中三名患者的初步数据,该临床试验旨在评估其基因疗法PBFT02用于治疗GRN基因突变的FTD患者的疗效和安全性。PBFT02使用腺相关病毒1(AAV1)载体将编码颗粒蛋白前体(progranulin,PGRN)的GRN基因功能拷贝输送到患者的细胞中。
此次公布的结果显示,接受PBFT02(剂量1)治疗后30天,前三位患者脑脊液中的PGRN水平比基线时增加了3.6-6.6倍,为10.7-17.3 ng/mL,超过了健康成人对照组(n=61)的生理水平(3.3-8.2 ng/mL)。1名患者的PGRN水平在治疗6个月后依然超过生理水平,为27.3 ng/m。接受强化类固醇免疫抑制方案治疗的患者普遍对PBFT02(剂量1)的耐受性良好。
Fostroxacitabine bralpamide(fostrox):公布1b/2a期临床试验数据

Medivir公司公布了其正在进行的1b/2a期研究的积极中期数据。该研究旨在评估fostrox联用激酶抑制剂Lenvima(lenvatinib)治疗目前一线或二线治疗无效或不能耐受的晚期HCC患者的安全性和疗效。Fostrox是一种核苷酸DNA聚合酶抑制剂口服前药,以肝脏为靶器官,旨在选择性将药物递送到肝细胞中治疗HCC,并将副作用降至最低。
该研究目前仍在进行中,约有50%的患者仍在接受治疗,所有患者都已接受了至少12周的随访。此次公布的结果显示,随访时间为12周时,DCR提高到了80%。该联合疗法具有持续的抗肿瘤活性,超过75%患者的靶病灶缩小。此外,该联合疗法的耐受性仍然良好,没有出现意外的新安全事件,减少剂量的需求也低于预期。治疗时间最长的患者在保持部分缓解(PR)16个月后仍在接受治疗。
IAMA-6:在意大利获批启动1期临床试验

IAMA Therapeutics公司宣布意大利药品管理局(AIFA)已接受其临床试验申请(CTA),将启动一项随机双盲、安慰剂对照的1期首次人体试验,该研究旨在评估其用于治疗自闭症和癫痫的主打候选疗法IAMA-6的安全性、耐受性、药代动力学和药效学。
IAMA-6在自闭症谱系障碍和耐药性癫痫方面取得了令人鼓舞的体外和体内概念验证结果。该小分子化合物旨在直接靶向抑制NKCC1和神经元过度兴奋。该公司预计将于2024年1月开始在健康成人中展开1期临床试验。
AMT-130:公布1/2期临床试验的新数据
uniQure公司公布了其在研基因疗法AMT-130用于治疗亨廷顿病(Huntington’s disease)的1/2期临床试验的新结果。AMT-130是uniQure首个聚焦中枢神经系统的基因疗法,由AAV5载体携带专门沉默HTT基因表达的微RNA(microRNA),利用该公司专有的miQURE沉默技术,抑制突变亨廷顿蛋白的产生。在这项试验中,研究人员利用核磁共振(MRI)成像引导,将基因疗法直接注射到大脑的壳核和尾状核中。这是一种将基因疗法精准递送到中枢神经系统的技术。
此次公布的新结果包括在美国、欧洲和英国招募的39名患者的长达30个月的随访数据。结果显示,相比于疾病自然史对照组患者,接受AMT-130治疗的患者表现出神经功能保留的证据,并且具有潜在的剂量依赖性临床获益。患者脑脊液的神经丝蛋白轻链(NfL)平均值继续呈现良好趋势,低剂量组患者在30个月时比基线低6.6%,高剂量组患者在18个月时接近基线。安全性方面,AMT-130两个剂量的耐受性普遍良好。
Fadraciclib:公布1期临床试验数据
Cyclacel Pharmaceuticals公布了其口服候选药物fadraciclib用于治疗晚期实体瘤和淋巴瘤患者的1期临床试验的中期数据。Fadraciclib是一种细胞周期蛋白依赖性激酶(CDK)2/9抑制剂。CDK对于细胞周期控制和转录调控至关重要,CDK2能够驱动细胞周期转变,CDK9则能够调节基因的转录。Fadraciclib可以通过抑制CDK2和CDK9引起癌细胞凋亡。
此次公布的数据显示,已在晚期子宫内膜癌、鳞状非小细胞肺癌(NSCLC)和T细胞淋巴瘤患者中观察到fadraciclib的单药活性,包括完全缓解(CR)、PR和疾病稳定(SD)。在晚期宫颈癌、肝癌、卵巢癌和胰腺癌患者中也观察到了令人鼓舞的活性信号。一名CDKN2B基因缺失的鳞状NSCLC患者在用药一个周期后肿瘤明显缩小。回顾性分析发现,4名接受fadraciclib治疗并获得缓解或SD的患者存在CDKN2A、CDKN2B和/或MTAP基因缺失。
AV5124:完成1期临床试验
Viriom公司完成了其新型流感病毒复制抑制剂AV5124的1期临床试验。AV5124是一种非常有效的流感病毒复制抑制剂,对所有测试过的流感病毒类型都有很强的抑制作用,包括对神经氨酸苷酶抑制剂Tamiflu或帽依赖性内切酶抑制剂Zoflusa耐药的病毒。
此前公布的1期临床研究结果表明,AV5124具有出色的安全性和耐受性。该研究中达到的血药浓度表明病毒在几天内受到持续有效的抑制。AV5124卓越的安全性和已知的抗流感病毒效力支持将该化合物推进到2-3期疗效研究,该研究将在今年流感季节开始。