RNA疗法是一种利用核糖核酸(RNA)分子来治疗各种疾病的新兴技术。RNA是一种生物大分子,参与了细胞内的遗传信息传递和蛋白质合成。RNA疗法的原理是通过改变细胞内的RNA水平或功能,来调节特定基因的表达或修复致病突变。RNA疗法有许多优势,如高度特异性、可逆性、灵活性和低毒性。在本文中,我们将介绍RNA疗法的五个有前途的应用,包括RNA干扰、信使RNA疗法、基于RNA的基因编辑、RNA疫苗和基于RNA的诊断。
一:RNA干扰
RNA干扰(RNAi)是一种自然存在的生物过程,可以沉默特定基因的表达。通过将小干扰RNA(siRNA)分子引入细胞,可以利用这一过程来选择性地降解导致疾病的mRNA分子。这种方法可以治疗各种类型的疾病,如遗传性疾病、病毒感染和癌症。

目前,已经有一种基于RNAi的药物被美国食品药品监督管理局(FDA)批准上市,用于治疗一种罕见的遗传性神经退行性疾病,称为遗传性甲状腺素介导的淀粉样变性(hATTR)。该药物名为patisiran,可以通过静脉注射给患者,有效地降低了hATTR相关基因的表达,从而减轻了患者的神经和心脏损伤。
除了patisiran之外,还有许多基于RNAi的药物正在临床试验中,针对不同的疾病领域。例如,有一种名为fitusiran的药物正在开发中,用于治疗血友病A和B。这两种血液凝固障碍是由于缺乏凝血因子VIII或IX而引起的。fitusiran可以通过降低抑制凝血因子活化的抗凝血酶(AT)的表达,来增强患者体内的凝血能力。
另一个例子是名为lumasiran的药物,用于治疗原发性高氧化草酰酸尿(PH1)。这是一种由于缺乏肝脏中参与甘氨酸代谢的酶而导致尿液中草酰酸过高的遗传性肾脏疾病。lumasiran可以通过降低该酶编码基因的表达,来降低草酰酸水平,并改善肾功能。
为了提高基于RNAi的药物的递送效率和靶向性,科学家们正在开发新的载体和纳米材料,如外泌体、脂质纳米颗粒和适配体等。这些载体可以保护siRNA分子免受血液中酶和免疫系统的降解,并将它们有效地运送到特定组织或细胞。
二:mRNA疗法
信信使RNA(mRNA)是一种携带遗传信息的RNA分子,可以指导细胞合成特定的蛋白质。mRNA疗法的原理是通过将编码特定蛋白质的mRNA分子递送到细胞中,来改变细胞的功能或诱导免疫反应。mRNA疗法有许多优势,如高度可定制、快速开发和低成本。
最近,mRNA疗法引起了全世界的关注,因为它在新冠肺炎(COVID-19)疫苗的开发中发挥了重要作用。两种基于mRNA的疫苗,分别由辉瑞(Pfizer)和BioNTech公司以及Moderna公司开发,已经被FDA批准紧急使用,用于预防COVID-19的感染。这两种疫苗都是通过将编码新冠病毒刺突蛋白的mRNA分子包裹在脂质纳米颗粒中,然后注射到人体中。这样,人体细胞就可以产生刺突蛋白,并引发免疫系统产生抗体和记忆细胞,从而对抗病毒。
除了COVID-19疫苗之外,mRNA疗法在其他领域也有广泛的应用前景,如癌症、遗传性疾病和其他传染性疾病。例如,有一种名为BNT111的mRNA药物正在开发中,用于治疗黑色素瘤。这种药物可以编码四种黑色素瘤相关抗原,并诱导针对肿瘤细胞的免疫反应。另一个例子是名为mRNA-3927的药物,用于治疗一种罕见的遗传性肝脏疾病,称为甲基丙二酸尿(MMA)。这种疾病是由于缺乏一种参与氨基酸代谢的酶而导致的。mRNA-3927可以通过编码该酶并恢复正常的代谢功能来治疗MMA。
还有一种名为CV7202的mRNA药物正在开发中,用于预防流感和其他呼吸道感染。这种药物可以编码多种呼吸道相关抗原,并激活黏膜免疫系统,从而提供广泛和持久的保护。
三:基于RNA的基因编辑
基因编辑是一种可以精确修改基因组序列的技术,从而改变细胞或生物体的特征。目前最流行和最强大的基因编辑技术是CRISPR-Cas9系统,它利用了一种由细菌进化出来的防御机制。CRISPR-Cas9系统由两个组成部分组成:一段编码Cas9核酸酶的DNA序列和一段称为导向RNA(gRNA)的RNA序列。gRNA可以与目标DNA序列互补结合,并引导Cas9酶到达该位置进行切割或修复。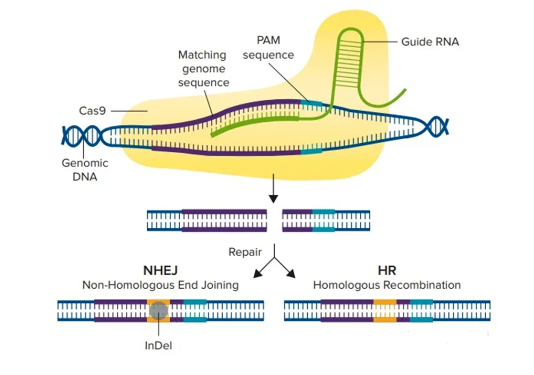
基于CRISPR-Cas9的基因编辑技术已经在许多领域得到了广泛的应用,如农业、生物技术和医学。其中,在医学领域, 基因编辑技术有望治疗许多遗传性或获得性的疾病,如血液病、免疫缺陷、肌肉萎缩和癌症。通过使用基因编辑技术,可以在细胞或动物模型中修复致病突变,或者增强细胞的功能或抵抗力。例如,有一种名为CTX001的基因编辑药物正在开发中,用于治疗镰状细胞性贫血和β地中海贫血。这两种疾病都是由于红细胞中携带氧气的血红蛋白的突变而导致的。CTX001可以通过从患者体内采集造血干细胞,然后使用CRISPR-Cas9系统将其编辑为产生胎儿血红蛋白(HbF),再将其回输到患者体内,来治疗这些疾病。HbF可以抵消突变血红蛋白的影响,并改善红细胞的功能和寿命。另一个例子是名为Zynteglo的基因编辑药物,用于治疗β地中海贫血的一种类型,称为β0/βE型。这种药物也是通过从患者体内采集造血干细胞,然后使用一种称为TAL效应子核酸酶(TALEN)的基因编辑工具将其编辑为产生正常的血红蛋白,再将其回输到患者体内,来治疗这种疾病。这种药物已经被欧洲药品管理局(EMA)批准上市,是第一个基于基因编辑的药物。
除了CRISPR-Cas9和TALEN之外,还有其他类型的基于RNA的基因编辑技术正在开发中,如碱基编辑和素数编辑。这些技术可以在RNA水平上进行更精确和灵活的修改,而不需要切割DNA。这些技术有可能在治疗囊性纤维化、肌肉萎缩症和遗传性听力损失等遗传性疾病方面发挥作用。
四:RNA疫苗
RNA 疫苗是一种利用 RNA 分子来诱导免疫反应的新型疫苗。与传统的灭活或减毒疫苗不同,RNA 疫苗不需要使用完整的微生物或其部分来刺激免疫系统。相反,RNA 疫苗只需要使用编码微生物特定抗原的 RNA 分子,并将其递送到人体细胞中。这样,人体细胞就可以根据 RNA 分子合成抗原,并展示给免疫系统,从而产生抗体和记忆细胞,以对抗未来的感染。

RNA 疫苗有许多优势,如安全性、有效性、可定制性和可扩展性。由于 RNA 分子本身不具有感染性或整合性,因此 RNA 疫苗不会引起持续性感染或基因组改变。此外,由于 RNA 分子可以快速和廉价地合成和修改,因此 RNA 疫苗可以灵活地应对新出现或变异的微生物威胁。
如前所述,目前已经有两种基于 mRNA 的疫苗被 FDA 批准紧急使用,用于预防 COVID-19 的感染。这两种疫苗都显示出了高达 95% 的有效性,而且没有引起严重的不良反应。这些疫苗的成功为 RNA 疫苗的发展开辟了新的可能性。
除了 COVID-19 之外,还有许多其他的 RNA 疫苗正在研究和开发中,针对不同的疾病,如流感、寨卡病毒、艾滋病毒和癌症。例如,有一种名为 mRNA-1647 的 mRNA 疫苗正在开发中,用于预防水痘和带状疱疹。这种疫苗可以编码水痘带状疱疹病毒的五种抗原,并在动物模型中显示出了强大的免疫保护效果。另一个例子是名为 CV8102 的 mRNA 疫苗正在开发中,用于治疗黑色素瘤、头颈癌和乳腺癌等实体肿瘤。这种疫苗可以编码四种肿瘤相关抗原,并通过皮下注射给患者。这样,患者体内的免疫细胞就可以识别和攻击肿瘤细胞,并产生持久的免疫记忆。
五:基于RNA的诊断
基于 RNA 的诊断是一种利用 RNA 分子来检测和监测各种疾病的方法。RNA 分子可以作为特异性和敏感性高的生物标志物,反映出细胞或组织的状态和功能。通过分析体液或组织中的 RNA 分子,可以实现早期、准确和个性化的诊断和治疗。
基于 RNA 的诊断有许多优势,如高通量、低成本、高分辨率和多功能性。由于 RNA 分子可以在不同层次上进行检测和定量,如基因、转录本、剪接变体、突变、表达水平等,因此基于 RNA 的诊断可以提供丰富和综合的信息,以揭示细胞或组织的分子特征和功能状态。
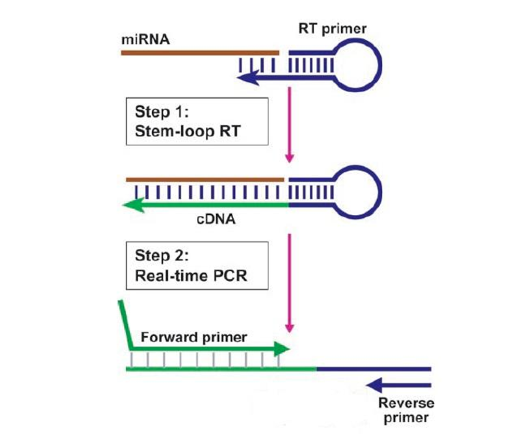
目前,已经有许多基于 RNA 的诊断方法被开发和应用,如逆转录聚合酶链反应(RT-PCR)、RNA 测序(RNA-seq)和液体活检等。这些方法可以用于检测和鉴定各种类型的 RNA 分子,如 mRNA、非编码RNA、嵌合基因融合、转录本亚型和剪接变体等。这些方法在各个领域都有广泛的应用,如传染性疾病、癌症、遗传性疾病和自身免疫性疾病等。例如,RT-PCR是目前检测COVID-19感染的金标准方法,可以快速和准确地检测出病毒的RNA序列。RNA-seq是一种高通量的RNA分析方法,可以同时检测数千个RNA分子,并揭示出它们的表达水平、突变、剪接和融合等特征。RNA-seq在癌症诊断和分型中有重要的作用,可以帮助医生制定个性化的治疗方案。液体活检是一种通过分析血液或其他体液中的游离RNA分子来检测和监测癌症的方法。液体活检有望实现非侵入性和实时的癌症检测,并反映出肿瘤的动态变化和药物反应。