国家药监局:2023年度医疗器械注册工作报告
2024-02-20
阅读(2156)
2024年2月5日,国家药监局发布《2023年度医疗器械注册工作报告》。
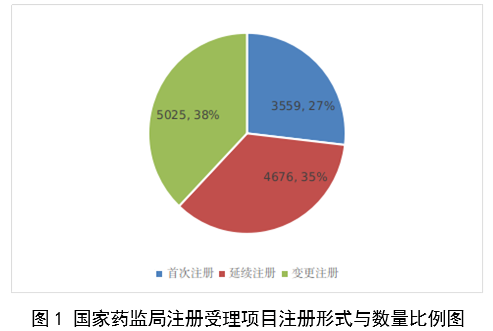
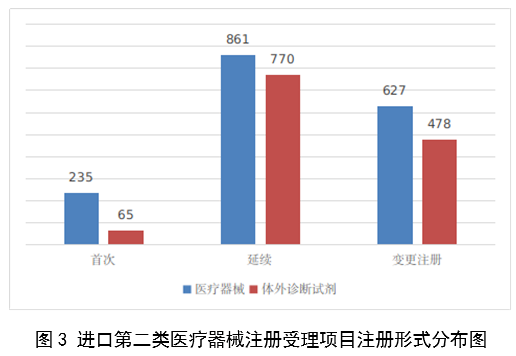
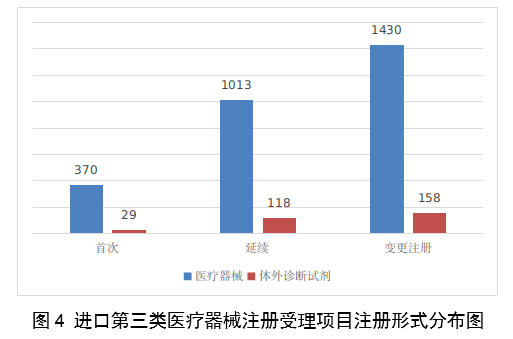
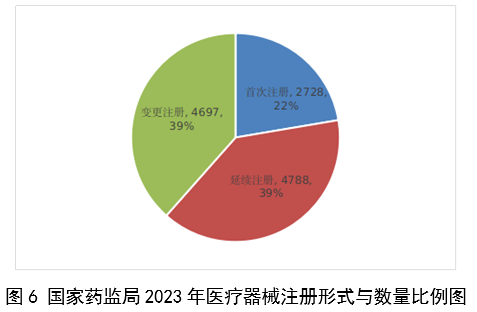
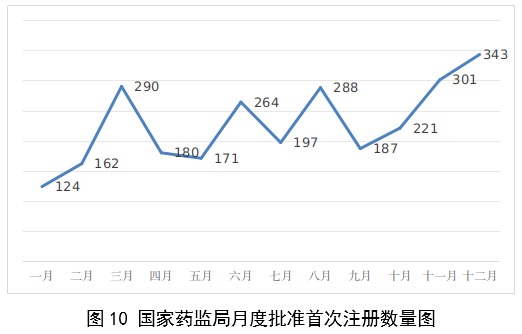
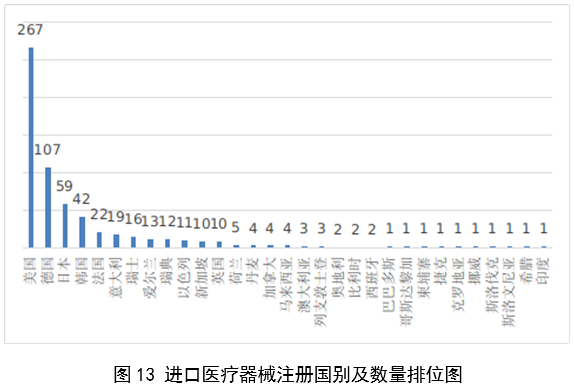
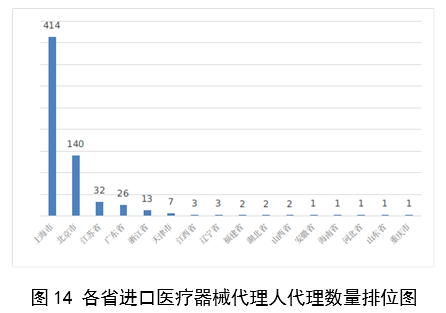
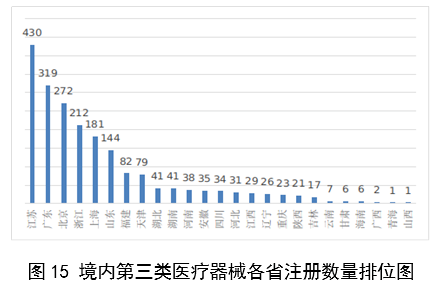
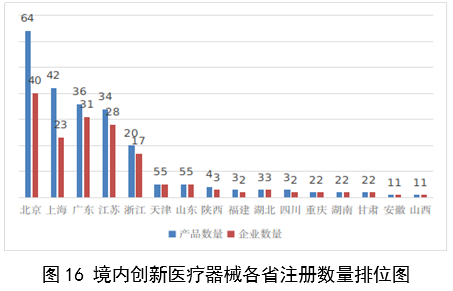
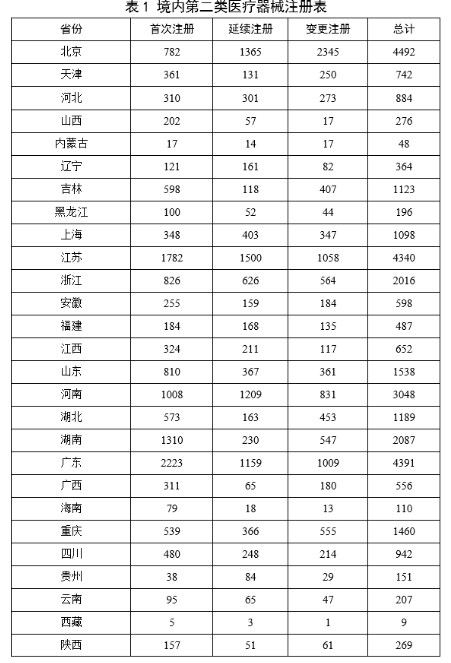
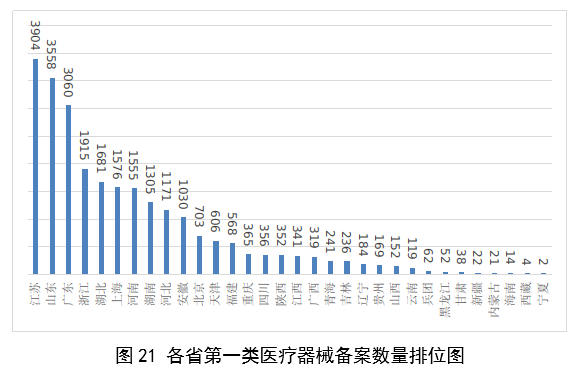
(一)医疗器械监管法规制度体系更加完善。2023年9月8日,十四届全国人大常委会将《医疗器械管理法》列入立法规划项目,国家药监局已成立工作领导小组、工作组、专家咨询组,着手起草相关法律文本。会同国家卫生健康委、国家疾控局联合印发《医疗器械紧急使用管理规定(试行)》,为医疗器械紧急使用提供法律支撑。起草《医疗机构临床急需医疗器械临时进口使用管理要求》。 (二)创新医疗器械质量数量实现双丰收。2023年,国家药监局共批准创新医疗器械61个,优先审批医疗器械12个,创新医疗器械批准数量再创新高,比2022年增加6个。在数量增加的同时,创新医疗器械“含金量”不断提升,在全球率先批准通过破坏交感神经治疗肺动脉高压的一次性使用环形肺动脉射频消融导管上市,单光子发射及X射线计算机断层成像系统、腹腔内窥镜单孔手术系统、颅内取栓支架等产品技术达到国际领先水平,更好地满足了公众使用高端医疗器械的需求。 (三)服务国家重大战略稳步实施。大力支持京津冀、长三角、粤港澳大湾区、海南自贸港、福建等重点区域建设。批准人工耳蜗声音处理器等3个海南临床真实世界应用试点产品上市,截至目前,累计批准产品9个,惠及更多患者。指导召开第二届博鳌国际药械真实世界研究大会。指导粤港澳大湾区使用20种、29批次港澳已上市的医疗器械,服务区域诊疗需要。设立医疗器械创新山东、北京、河北、湖北服务站,创新服务站数量已达11个,服务区域产业高质量发展成效初步显现。推进人工智能医疗器械、生物材料创新任务揭榜挂帅工作,共遴选出48个人工智能医疗器械、40个生物材料揭榜项目。筹建高端医疗装备创新合作平台,加速高端医疗器械创新转化速度。完善前置申请机制,加大前置审评辅导力度,9个产品通过辅导已申请注册。 (四)常态化疫情防控保障有力。应急批准广东、北京、江苏3家企业的3个国产体外膜肺氧合系统(ECMO)上市,助力疫情防控“保健康、防重症”目标落实。全年批准新冠病毒检测试剂21个,其中核酸检测试剂9个,抗原检测试剂12个。截至目前累计批准新冠病毒检测试剂157个,充分满足疫情防控需要。协同国家卫生健康委、国家疾控局联合推进猴痘检测试剂产品研发和产品注册上市。持续做好新冠病毒变异株监测和检测试剂能力评估,确保产品有效检出能力。 (五)医疗器械注册备案管理水平显著提升。部署各地开展第二类医疗器械注册清理规范全面整改,召开全国第二类医疗器械注册管理工作会议,印发强化医疗器械注册管理工作意见,部署全面加强注册管理有关工作。对一次性使用微波消融针、重组胶原蛋白创面敷料等,出台相关文件和指导原则,统一规范注册工作要求。指导基层做好第一类医疗器械备案工作。持续规范第一类产品备案,切实加强对市级监管部门的监督指导。 (六)医疗器械临床试验管理力度继续加大。开展27个品种的临床试验产品真实性核查,31个品种的临床试验监督抽查,较2022年数量加倍。发布监督抽查情况通报一期,对存在问题的产品严肃处理,作出不予注册、一年内不予受理的决定。截至2023年底,医疗器械临床试验机构备案数量达到1340家,与2022年相比增加13.8%。 (七)医疗器械标准质量不断提升。修订发布《医疗器械标准报批发布工作细则》《医疗器械标准验证工作细则》,制定《医疗器械标准实施评价工作细则》等文件,标准制修订管理更加精细。成立全国医用防护标准化工作组及口腔数字化医疗器械、医疗器械可靠性与维修性等2个标准化技术归口单位。发布28项医疗器械国家标准、131项行业标准及14项行业标准修改单。截至2022年底,现行有效医疗器械标准共1974项,其中国家标准271项,行业标准1703项,与国际标准一致性程度超过90%,标准体系覆盖性、系统性不断提升。我国主导制定的ISO 24072《输液器进气器件气溶胶细菌截留试验方法》国际标准正式发布,2名中国专家当选国际电工组织(IEC)技术委员会副主席和分技术委员会主席,《人工智能医疗器械 肺部影像辅助分析软件 算法性能测试方法》标准获批国际标准立项。发布《国家药品监督管理局关于GB 9706.1-2020及配套并列标准、专用标准实施有关工作的通告》及两期解读,印发《GB 9706.1-2020标准检验要点》,公开发布41个新版GB 9706系列标准的检验报告模板,建立专家咨询机制,有效推动新版GB 9706系列标准的平稳有序实施。 (八)医疗器械分类管理扎实推进。发布《关于进一步加强和完善医疗器械分类管理工作的意见》,强化分类管理顶层设计。完成医疗器械分类技术委员会换届工作,修订发布《医疗器械分类技术委员会工作规则》。动态调整分类目录,发布《关于调整〈医疗器械分类目录〉部分内容的公告》,涉及58个产品。发布《重组胶原蛋白生物材料命名指导原则》解读,进一步指导和规范医疗器械领域重组胶原蛋白生物材料的命名。组织成立中医(民族医)器械专项工作小组,统筹开展中医(民族医)器械分类、命名、标准、审评、检验、核查等工作。 (九)医疗器械唯一标识工作有序开展。开展唯一标识第一批、第二批实施工作总结,通报先进经验做法。发布《关于做好第三批实施医疗器械唯一标识工作的公告》,将临床需求量较大的一次性使用产品、集中带量采购中选产品、医疗美容相关产品等103种风险较高的第二类医疗器械纳入第三批实施范围。组建医疗器械唯一标识专家咨询团队,为深入推进唯一标识实施工作提供支撑。制定《医疗器械唯一标识的形式和内容》《医疗器械唯一标识的包装实施和应用》两项医疗器械行业标准,进一步指导医疗器械唯一标识工作实施。 (十)监管科学研究工作成果显著。组织推进第二批监管科学6个重点项目13个医疗器械子项目工作,已形成医疗器械监管新工具、新标准、新方法141项。组织药品监管科学体系建设第一批重点项目医疗器械领域重点项目申请和遴选;启动新一代基因测序产品评价方法研究、数字疗法医疗器械质量评价方法研究等9项重点项目。配合开展监管科学研究基地和重点实验室考核,促进研究质量提升。 (十一)医疗器械技术审查能力持续提升。技术审评质量管理体系与业务工作高效融合,审评质量监测、运行和改进体系持续完善。医疗器械注册审评购买服务工作稳步实施。长三角、大湾区审评分中心审评人员数量分别增加176%、109%。全年发布67项指导原则和6项审评要点,现行有效指导原则达到613项,对医疗器械分类目录覆盖率达92.2%。持续开展全系统医疗器械注册管理实务培训、充分发挥实训基地作用,线上举行12期省级医疗器械审评审批人员线上培训,8300余人参训,举办首次省级医疗器械审评员线下实地培训,提升培训效果。公开已发布的GB 9706相关医疗器械标准解读视频,150余万人次在线浏览学习。 2023年,国家药监局依职责共受理医疗器械首次注册、延续注册和变更注册申请共计13260项,与2022年相比增加25.4%。 受理境内第三类医疗器械注册申请7106项,受理进口医疗器械注册申请6154项。 按注册品种区分,医疗器械注册申请9968项,体外诊断试剂注册申请3292项。 按注册形式区分,首次注册申请3559项,占全部医疗器械注册申请的27%;延续注册申请4676项,占全部医疗器械注册申请的35%;变更注册申请5025项,占全部医疗器械注册申请的38%。注册形式与数量比例情况见图1。 境内第三类医疗器械注册受理共7106项,与2022年相比增加31%。其中,医疗器械注册申请5432项,体外诊断试剂注册申请1674项。 从注册形式看,首次注册2860项,占全部境内第三类医疗器械注册申请数量的40.2%;延续注册1914项,占全部境内第三类医疗器械注册申请数量的26.9%;变更注册2332项,占全部境内第三类医疗器械注册申请数量的32.8%。注册形式分布情况见图2。 进口第二类医疗器械注册受理共3036项,与2022年相比增加23.1%。其中医疗器械注册申请1723项,体外诊断试剂注册申请1313项。 从注册形式看,首次注册300项,占全部进口第二类医疗器械注册申请数量的9.9%;延续注册1631项,占全部进口第二类医疗器械注册申请数量的53.7%;变更注册1105项,占全部进口第二类医疗器械注册申请数量的36.4%。注册形式分布情况见图3。 进口第三类医疗器械注册受理共3118项,与2022年相比增加16.4%。其中医疗器械注册申请2813项,体外诊断试剂注册申请305项。 从注册形式看,首次注册399项,占全部进口第三类医疗器械注册申请数量的12.8%;延续注册1131项,占全部进口第三类医疗器械注册申请数量的36.3%;变更注册1588项,占全部进口第三类医疗器械注册申请数量的50.9%。注册形式分布情况见图4。 2023年,国家药监局共批准医疗器械首次注册、延续注册和变更注册12213项,与2022年相比注册批准总数量增长2.3%。 其中,首次注册2728项,与2022年相比增加9.1%。延续注册4788项,与2022年相比减少8.2%,连续两年减少。变更注册4697项,与2022年相比增加11.2%。 2023年,企业自行撤回首次注册申请、自行注销注册证书287项。 2023年,国家药监局批准境内第三类医疗器械注册6151项,与2022年相比增加8.1%,进口医疗器械6062项,与2022年相比减少3%。 按照注册品种区分,医疗器械9130项,占全部医疗器械注册数量的74.8%;体外诊断试剂3083项,占全部医疗器械注册数量的25.2%。 按照注册形式区分,首次注册2728项,占全部医疗器械注册数量的22.3%;延续注册4788项,占全部医疗器械注册数量的39.2%;变更注册4697项,占全部医疗器械注册数量的38.5%。注册形式比例情况见图6。 境内第三类医疗器械注册6151项。其中,医疗器械4667项,体外诊断试剂1484项。 从注册形式看,首次注册2079项,占全部境内第三类医疗器械注册数量的33.8%,延续注册1897项,占全部境内第三类医疗器械注册数量的30.8%;许可事项变更注册2175项,占全部境内第三类医疗器械注册数量的35.4%。注册形式分布情况见图7。 进口第二类医疗器械注2947项。其中,医疗器械注册1654项,体外诊断试剂注册1293项。 从注册形式看,首次注册300项,占全部进口第二类医疗器械注册数量的10.2%;延续注册1707项,占全部进口第二类医疗器械注册数量的57.9%;许可事项变更注册940项,占全部进口第二类医疗器械注册数量的31.8%。注册形式分布情况见图8。 进口第三类医疗器械注册3115项。其中,医疗器械注册2809项,体外诊断试剂注册306项。 从注册形式看,首次注册349项,占全部进口第三类医疗器械注册数量的11.2%;延续注册1184项,占全部进口第三类医疗器械注册数量的38%;许变更注册1582项,占全部进口第三类医疗器械注册数量的50.8%。注册形式分布情况见图9。 2023年,国家药监局共批准医疗器械首次注册2728项,月度批准数量情况见图10。 注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中18个子目录的产品。 注册数量前五位的境内第三类医疗器械是:无源植入器械,神经和心血管手术器械,注输、护理和防护器械,有源手术器械,医用成像器械。与2022年相比,有源手术器械超过医用成像器械,注册数量同比增加54%,其他品类注册数量也有所增加,如注输、护理和防护器械增加26.2%,神经和心血管手术器械增加11%,无源植入器械增加18.8%。 注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中22个子目录的产品。 注册数量前五位的进口医疗器械,主要是:无源植入器械,口腔科器械,眼科器械,医用成像器械,有源手术器械,与2022年相比,变化较大,眼科器械取代注输、护理和防护器械,有源手术器械取代神经和心血管手术器械,无源植入器械数量增加43.3%,口腔科器械数量增加57.8%,医用成像器械注册数量减少44.2%。 2022年,共有31个国家(地区)产品在我国获批上市。 其中,美国、德国、日本、韩国、法国医疗器械在中国医疗器械进口产品首次注册数量位列前5位,注册产品数量约占2023年进口产品首次注册总数量的77%,与2022年相比略有增加。 从进口医疗器械代理人分布看,共有16个省涉及有本省企业作为进口医疗器械代理人,其中上海市的进口医疗器械代理人代理的进口医疗器械首次数量最多,占全部进口医疗器械首次注册数量的64%。 从2023年境内第三类医疗器械首次注册情况看,相关注册人主要集中在沿海经济较发达省份。青海首次有境内第三类医疗器械获准注册。 其中,江苏、广东、北京、浙江、上海是境内第三类医疗器械首次注册数量排前五名的省份,占2023年境内第三类医疗器械首次注册数量的68%,但与2022年相比略有减少。 2023年,国家药监局按照《创新医疗器械特别审查程序》《医疗器械优先审批程序》继续做好相关产品的审查工作,共收到创新医疗器械特别审批申请466项,比2022年增加35.9%,其中69项获准进入创新医疗器械特别审查程序。 从2014年至2023年,国家药监局共批准250个创新医疗器械。其中,境内创新医疗器械涉及16个省的167家企业,进口创新医疗器械涉及5个国家的18个企业。 北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量最多,约占全部已批准的250个创新医疗器械的78.4%,但与2022年相比有所下降。 2023年,国家药监局共批准61个创新医疗器械产品上市,相比2022年增加11%。其中有源医疗器械43个,无源医疗器械16个,体外诊断试剂2个。有源手术器械、无源植入器械、医用软件、医用成像器械、放射治疗器械等高端医疗器械是2023年批准的创新医疗器械数量前五位。具体见图17。 这些创新产品核心技术都有我国的发明专利权或者发明专利申请已经国务院专利行政部门公开,产品主要工作原理/作用机理为国内首创,具有显著的临床应用价值。以下是已批准创新医疗器械产品介绍: (一)病人监护仪:该产品由主机、插件模块和附件组成。可对患者进行心电(含ST段测量及心律失常分析)、阻抗呼吸、体温、脉搏血氧饱和度、脉率、无创血压、有创血压、呼吸及呼吸末二氧化碳、麻醉气体、无创心输出量(仅适用于成人患者)、有创心输出量(仅适用于成人患者)监护,同时具有心电图、PICC、呼吸氧合图、肾功能计算、血液动力学计算、氧合计算、通气计算、药物计算、记录仪功能。该产品预期在医疗机构由经培训合格的专业临床医生和护士使用,其应用领域包括手术室、ICU和普通科室。 该产品采用了心电信号自适应滤波技术和四电极心电系统技术,可通过实时观察腔内心电图P波的变化,反馈导管末端位置,实现置管操作过程中对导管末端的实时定位。与传统中心静脉置管术方法相比,该产品具有中心静脉置管末端定位功能,有助于提高PICC导管到位率。 (二)混合闭环胰岛素输注系统:该产品由胰岛素泵套件、发送器套件和葡萄糖传感器组成,具有两项主要核心技术:一是自动模式使用的混合闭环算法;二是用于检查传感器状态的电化学阻抗谱技术,该技术可确保葡萄糖传感器有充分的准确度。该产品通过人体佩戴的葡萄糖传感器对皮下组织间液的葡萄糖浓度趋势持续监测,根据接收的动态葡萄糖监测水平,混合闭环胰岛素泵可持续向14岁及以上Ⅰ型糖尿病患者体内输注基础量胰岛素(用户可选速率)与胰岛素大剂量输注(用户可选剂量),通过安全防护技术,可根据持续葡萄糖监测情况自动调整基础率胰岛素的输注,确保全天候的血糖可控,便利糖尿病患者的生活。 (三)血液透析尿素清除率计算软件:该产品是具有自主知识产权的国内首创产品,性能指标达到国际先进水平。临床用于维持性血液透析成年患者的血液透析尿素清除率计算,不适用于残肾功能计算。尿素清除率是衡量血液透析充分性的重要指标。目前主要采用有创方式取血法进行计算,存在操作繁琐、无法连续计算等问题,可能导致患者出现贫血。与取血法相比,该产品可结合患者已有指标和血液透析治疗参数计算尿素清除率,依据局部尿素动力学模型计算患者模拟体液量,具有无创、操作简单、可连续计算等优势,能够及时调整透析方案,有效提高患者透析效果。 (四)胶原蛋白软骨修复支架:该产品在生产中创新性地采用了胶原提取的过程除菌工艺,并去除了具有免疫原性的端肽结构,能够批量化、稳定地生产出具有完整三螺旋结构的胶原蛋白材料。该产品以胶原蛋白为主要成分,将其作为生物支架为自体骨髓间充质干细胞(BMSCs)提供细胞粘附、增殖、迁移的空间。胶原蛋白软骨修复支架植入后,其中的软骨细胞由BMSCs分化以及周围健康软骨组织中迁移并增殖。软骨细胞不断合成分泌II型胶原蛋白,形成新的软骨组织,进而修复缺损软骨。在此过程中,胶原蛋白支架逐步降解,降解产物可被软骨细胞作为营养物质吸收,也可经过代谢排出体外。现有的软骨损伤修复技术常见包括微骨折术、软骨移植、软骨细胞移植以及关节置换等。胶原蛋白软骨修复支架配合膝关节微骨折术使用,产品的上市预期让更多的患者受益。 (五)磁共振监测半导体激光治疗设备:该产品的磁共振监测核心技术具有国家发明专利,在激光治疗过程中,通过磁共振温度成像技术,实时接收磁共振设备的梯度回波序列,从而计算治疗区域温度,对治疗过程实时监控。该产品与一次性使用激光光纤套件配合,用于对药物难治性癫痫患者(有明确的致痫区部位或明确的癫痫传导途径)的局部病灶进行激光治疗且治疗时间短,对健康脑组织损伤小,术后并发症少,患者恢复快,降低了神经外科颅内病灶的治疗难度。 (六)冠状动脉CT血流储备分数计算软件:该产品基于冠脉CT血管造影图像计算获得CT血流储备分数,用于辅助评估稳定性冠心病患者的功能性心肌缺血状态,可以帮助临床医生判断冠脉狭窄是否引起心肌缺血,确定患者是否需要进一步进行介入检查和治疗。作为传统影像学检查的补充,相应软件的上市,将有助于进一步减少患者诊断时间和支出负担。 (七)一次性使用激光光纤套件:该产品的材料、结构和制作工艺等核心技术具有国家发明专利。在长时间工作状态下,光纤受热几乎不发生形变,沿其轴向散射出的激光强度能够保持相对一致,不仅可以增加治疗范围,同时也可降低激光功率密度,有效提高了使用安全性。该产品与磁共振监测半导体激光治疗设备配合使用,实现了神经外科颅内病灶的全微创治疗,用于对药物难治性癫痫患者(有明确的致痫区部位或明确的癫痫传导途径)的局部病灶进行激光治疗。治疗时间短,对健康脑组织损伤小,术后并发症少,患者恢复快,降低了神经外科颅内病灶的治疗难度。 (八)人工晶状体:该产品为一件式后房人工晶状体,采用专利波前塑形技术,可较为充分地利用进入眼内的光线,同时预期将改善衍射型人工晶状体普遍存在的光晕和/或其他视觉干扰的副反应。该产品适用于术前角膜散光<1.00D且经囊外白内障摘除术摘除白内障晶状体后无晶状体眼的成人患者,一期植入人工晶状体进行视力矫正。该产品通过扩展焦深来减轻老视对患者近视力、中视力及远视力的影响,在保持相当远视力的前提下,扩展从远距离至功能性近距离的视力范围,降低患者对眼镜的依赖。产品的上市将为患者带来新的治疗选择。 (九)冠状动脉功能测量系统:该产品由工作站、传感器支架、IBP导联线、IBP信号输入电缆(选配)组成,仅限与该公司的一次性使用有创压力传感器配合使用。该产品通过对冠状动脉造影影像进行血管分割、三维重建,获取血流速度,结合有创压力传感器测量的主动脉压进行血流动力学分析,实现对冠状动脉造影微循环阻力指数(caIMR)的评估,辅助临床医生评价患者冠状动脉微循环功能情况。 (十)金属增材制造胸腰椎融合匹配式假体系统:该产品包括胸腰椎融合匹配式假体,以及配合组件钉扣、螺钉。该产品创新性采用聚乙烯钉扣作为柔性连接装置,联合后路钉棒系统,实现前后路联合固定的“桁架”结构。对于需进行多节段胸腰椎切除重建的患者人群,该产品采用多孔结构,同时可实现患者匹配设计(基于患者CT数据设计制造)和植入假体固定,可在一定程度提高患者术后生活质量和患者生存率。该产品适用于上胸椎至下腰椎(T1-L5)因肿瘤或其它病变需行连续三个及以上节段椎体切除后的结构重建,需与脊柱内固定系统匹配并实现永久植入。产品的上市将为患者治疗提供新的选择。 2023年,各省级药品监管部门共批准境内第二类医疗器械注册33584项,与2022年相比增加2.1%。其中,首次注册13952项,与2022年相比增加4.6%。首次注册项目占全部境内第二类医疗器械注册数量的41.5%。延续注册9437项,与2022年相比减少11.3%,占全部境内第二类医疗器械注册数量的28.1%;变更注册10195项,与2022年相比增加14.3%,占全部境内第二类医疗器械注册数量的30.4%。境内第二类医疗器械注册形式及数量情况见图18。 从注册情况看,广东、江苏、北京、湖南、河南、浙江、山东、重庆、上海、湖北10省(直辖市)办理境内第二类医疗器械注册事项较多。 从首次注册情况看,广东、江苏、湖南、河南、浙江、山东、北京、吉林、湖北、重庆10省(区、市)首次注册的境内第二类医疗器械数量较多。各省第二类医疗器械首次注册数量排位见图20。 2023年,国家药监局依职责共办理进口第一类医疗器械备案数量2453项,与2022年相比增加21.2%。 全国设区的市级药品监管部门依职责共办理境内第一类医疗器械备案数量25681项,与2022年相比减少9.9%。此外,2023年各省取消第一类医疗器械备案9876项。其中江苏、山东、广东、浙江、湖北是第一类备案数量前五的省份。各省第一类医疗器械备案数量排位见图21。 2023年,国家药监局依职责共办理进口第二、三类和境内第三类医疗器械变更备案6352项,与2022年相比增加17.8%。 其中,境内第三类医疗器械变更备案4443项,进口第二类、三类医疗器械变更备案1909项。 各省级药品监管部门依职责共办理境内第二类医疗器械变更备案15583项,与2022年相比增加33.9%。 自2018年1月1日《医疗器械临床试验机构条件和备案管理办法》颁布实施以来,全国共计1340个机构完成了医疗器械临床试验机构备案工作,比2022年增加13.8%。 其中广东、山东、江苏、河南、浙江临床试验机构备案数量居全国前五名。全国医疗器械临床试验机构分布情况见图22。 注:本报告的数据统计自2023年1月1日至2023年12月31日。
来源: 官方媒体 网络新闻 仅作分享学习 侵删